干细胞在眼科疾病的研究和应用
来源:步步先生 干细胞者说

关键词
角膜缘干细胞(LSC,limbal stem cell)
主要存在于角膜缘(Limbus)等多个角膜部位的一种干细胞;主要特征是高表达P63,低表达CD71。
视网膜色素上皮细胞(RPE,retinal pigment epithelium)
由单层色素上皮细胞所构成,排列十分规则。细胞呈多角形。主要特征是ZO-1,bestrophin , MiTF等标志物呈阳性;OCT4,NANOG, and SOX2等标志物呈阴性。 间充质干细胞(MSC,mesenchymal stem cells)
主要存在于存在于多种组织(如骨髓、脐带、胎盘、脂肪及各种脏器中)是一种具有自我复制能力和多向分化潜能的成体干细胞,能够发育成硬骨、软骨、脂肪和其他类型的细胞。主要特征是贴壁生长;表达CD105、CD73和CD90,不表达CD45、CD32、CD14或CD11b、CD79α或CD19及HLA-DR表面标记;MSC在体外可以分化为成骨细胞、脂肪细胞及成软骨细胞。
干细胞很有希望帮助我们去认识和治疗多种疾病、损伤和其他健康问题。干细胞治疗的潜力是显而易见的,造血干细胞移植已挽救了成千上万名白血病患儿的生命。在眼部疾病,尤其是治疗角膜损伤和神经退化相关的眼科疾病方面,干细胞技术同样得到了一定的研究和应用。以下是干细胞在眼科疾病方面的研究和应用现状的简要综述。 干细胞已经用于眼科疾病临床研究的疾病主要有:如角膜缘干细胞(limbal stem cell)、口腔黏膜上皮细胞(mucosalepithelial cells)、角膜上皮干细胞(corneal epithelial stem cell)等移植治疗角膜损伤;胚胎来源的色素上皮细胞(ES derived RPE)、间充质干细胞(mesenchymal stemcells)治疗视网膜病变、以及造血干细胞和间充质干细胞移植治疗于自身免疫引起的一些眼部病变。
目前,干细胞在眼科疾病的应用主要集中于以下几个方面:
1干细胞在角膜损伤方面的研究和应用 角膜缘干细胞(limbal stem cell):主要存在于角膜缘(Limbus)等多个角膜部位的一种干细胞[1];主要特征是高表达P63,低表达CD71[2]。目前主要用于治疗眼外伤(化学物质、烧伤等)导致的角膜损伤;角膜缘干细胞缺陷(LSCD);角膜斑痕等导致的角膜混浊或变白等疾病。
自体角膜缘干细胞移植已成为一种成熟的手术方法,单眼角膜缘干细胞缺陷患者和双眼角膜缘干细胞轻微缺陷患者可以将自体角膜缘干细胞或其他部位(口腔黏膜等)培养后进行移植,达到重建眼表、恢复视力的目的,这不需要免疫抑制剂但有可能对另一只正常眼睛造成伤害;而对于双眼角膜缘干细胞严重缺陷患者,由于只能用异体角膜缘干细胞培养后移植,尚需要解决免疫排斥、免疫抑制剂使用的问题。
2014年7月,中山大学眼科学团队与美国研究人员在nature杂志发表的一篇文章《WNT7A and PAX6 definecorneal epithelium homeostasis and pathogenesis》[3]。该研究成果证实了调控角膜缘干细胞分化的关键因子WNT7A和PAX6在角膜谱系专向分化中起着重要的作用,首次将皮肤干细胞诱导分化为角膜缘干细胞,并成功修复角膜功能,为治疗角膜疾病提供新策略。为修复和再生角膜表面,治疗角膜缘干细胞缺陷患者提供了一个潜在的资源。
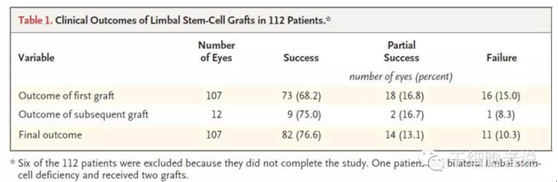
在2010年,N Engl J 杂志发表了一篇文章《Limbal Stem-Cell Therapy and Long-Term Corneal Regeneration》[4],意大利研究人员用病人自身角膜缘干细胞治疗角膜损伤。在患者的眼白和角膜间的异组织边缘提取干细胞,待其发育为纤维组织后,再植入患者的眼睛受损部位。112名被化学灼伤而导致失明的患者进行治疗,结果超过四分之三的患者恢复了视力。该技术一次移植成功率为68.2%,二次移植成功率为75%,还有13.1%患者的视力获得部分改善,仅有10.3%的患者视力无法获得改善。(如表1.)该研究发现P63阳性细胞比例对于治疗成功很重要。
2干细胞在视网膜疾病方面的研究和应用
视网膜疾病在临床上很常见,在此主要讲干性年龄相关性黄斑变性(Dry age-related macular degeneration,AMD)和少年型黄斑营养不良(Stargardt病)。这两种疾病都与视网膜色素上皮细胞(RPE)退行性变化相关。前者主要累及老年人,后者则是一种通常在儿童期发病的遗传性疾病。这两种疾病均可引起视网膜色素上皮(RPE)功能损害,从而导致失明。视网膜色素上皮细胞(retinal pigment epithelium),是由单层色素上皮细胞所构成,排列十分规则。细胞呈多角形。主要特征是ZO-1,bestrophin , MiTF等标志物呈阳性; OCT4, NANOG, and SOX2等标志物呈阴性。
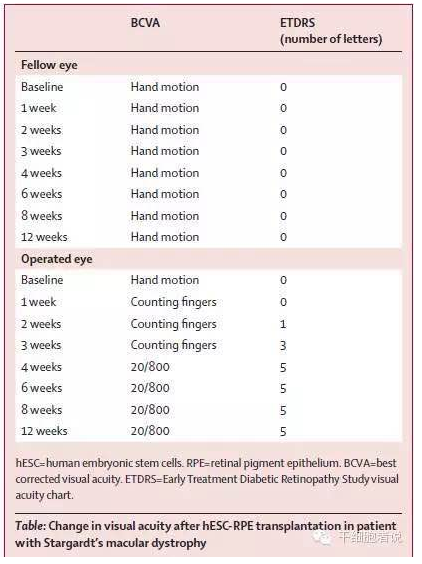
2010年,美国ACT公司(advanced cell technology)获得FDA许可,利用胚胎干细胞衍生的视网膜色素上皮细胞(RPE)对治疗两种退行性眼疾病:干性年龄相关性黄斑变性(Dry age-relatedmacular degeneration,AMD)和少年型黄斑营养不良(Stargardt病)。这是FDA批准的涉及到源自人类胚胎干(hES)细胞的第二项临床试验。2012年,该研究机构在《柳叶刀》(The Lancet)杂志发表了一篇文章《Embryonic stem cell trials for macular degeneration: a preliminaryreport》[5],美国研究人员利用人类胚胎干细胞(hESC)治疗了两名患有不同退化性眼疾病的患者,初期数据表明hESC治疗不仅安全,且显示出了一些治疗效力。他们将hESCs诱导生成了早期骨细胞和神经组织细胞,随后这些细胞分化形成了视网膜上皮细胞,其纯度超过99%。研究人员将大约5万个分离出来的视网膜上皮细胞注入到两名患者的视网膜下,其中一名老年女患者在其70多岁时患上了干性年龄相关性黄斑变性,而另一名中年女患者则患有少年型黄斑营养不良,因而导致了二者失明。4个月后,研究人员发现RPE已被注入的视网膜上皮细胞完全取代,数据证实注入的细胞存活了下来,并很大程度上改善了她们的视力。(如表2.)
3干细胞在其他眼科疾病方面的研究和应用
青光眼作为视网膜神经节细胞进行性凋亡(或死亡)性疾病,在理论上存在着应用细胞替代疗法尤其是干细胞治疗的可能性。干细胞治疗青光眼可能的作用位点应位于视网膜神经节细胞、视乳头和小梁网:(1)目前大部分研究集中于视网膜神经节细胞的替代治疗,但目前移植后并没有得到预期的结构和功能的修复,同时也缺乏对细胞增殖、分化进行全程监控的手段。(2)小梁网细胞重建则主要是替代变性的巩膜-角膜细胞。(3)干细胞可能替代变性的视乳头细胞(主要是星形胶质细胞)或促进视神经髓鞘化。
骨髓细胞中的造血和间充质成分有助于受损器官的修复,有人尝试用间充质干细胞治疗慢性青光眼。2013年,Stem Cells杂志发表了一篇文章《Transplantation of Mesenchymal Stem Cells Promotes TissueRegeneration in a Glaucoma Model Through Laser-Induced Paracrine FactorSecretion and Progenitor Cell Recruitment》[6].来自加拿大的研究人员在青光眼模型中移植入间充质干细胞,通过激光诱发的旁分泌因子分泌和祖细胞增殖可以促进青光眼的组织再生。实验显示,骨髓中的间充质干细胞诱发小梁网细胞的再生,注射进眼前房比造血细胞更能有效引起眼内压(IOP)下降(p<0.001)。此外,间充质干细胞和它们分泌的因子诱发睫状体中祖细胞池再活化,促进细胞增殖。激光诱发的组织重构将间充质干细胞按照预定目标导入受损区域,并使眼祖细胞也有一定的增加。该研究证实间充质干细胞及其分泌组分是开角型青光眼通过局部神经祖细胞进行组织修复的关键介质。
参考文献:
(1)Majo F et al(2008): Oligopotentstem cells are distributed throughout the mammalian ocular surface.Nature 456:250–255
(2)Pelligrini Get al (2001):p63identifies keratinocyte stem cell.ProcNatl Acad Sci USA98:3156–3161
(3)Hong Ouyang,et al. (2014):WNT7A and PAX6 define corneal epithelium homeostasis andpathogenesis. Nature.
(4)Paolo Rama,et al(2010):Limbal Stem-Cell Therapy and Long-Term Corneal Regeneration. N Engl J MED 363: 147-155
(5)Schwartz SD et al (2012): Embryonic stemcell trials for macular degeneration: a preliminary report,TheLancet,379(9817):713-720.
(6)Manuguerra-Gagn_e,Boulos, Ammar et al.(2013):Transplantation of Mesenchymal Stem CellsPromotes Tissue Regeneration in a Glaucoma Model Through Laser-InducedParacrine Factor Secretion and Progenitor Cell Recruitment. Stem Cells;31(6):1136-1148


