干细胞抗衰老的手段--自噬
自噬是细胞对抗恶劣环境的重要手段,例如在营养缺乏或高温氧化等恶劣环境下,细胞可以启动自噬,达到应对细胞应激保护自身的目的。研究发现,自噬也是许多物种对抗衰老的一种措施。最新研究发现,造血干细胞也利用这种方法维持自身的年轻化。这给许多造血相关疾病的治疗带来新的思路。其实人体内的干细胞类型非常多,这些细胞对维持各种特定组织的稳态十分关键,如果干细胞维持干性都需要类似的机制,那么激活干细胞自噬可以作为一种比较可行的抗衰老手段。但是肿瘤干细胞是癌症恶变和转移的重要因素,激活干细胞自噬会不会导致肿瘤的发生和恶变。这需要进行针对性研究,弄清楚肿瘤干细胞和正常组织干细胞的差异,才能建立安全的干预措施。
考虑到本研究认为线粒体自噬能减少干细胞内线粒体数量,降低线粒体活性,诱导细胞进入休眠状态,减少线粒体代谢引起的氧化应激。另外一种影响干细胞的重要因素是低氧条件,研究表明骨髓属于生理低氧环境,在这样的环境下有利于细胞维持干细胞特征,其他如神经干细胞集中分布的大脑室下区也属于血流不丰富的低氧区域,利用低氧培养比普通常氧培养干细胞增殖能力更强。研究一般从低氧诱导因子角度分析低氧能提高干细胞的耐受能力。如果把这些研究结合起来,可以认为低氧环境对于线粒体活性比较低的干细胞有利,因为线粒体本质上属于对抗氧气毒性的细胞器,数量少对氧浓度更敏感,所以干细胞不喜欢在氧浓度比较高的环境下生存。这或许是一个现象的两个角度。
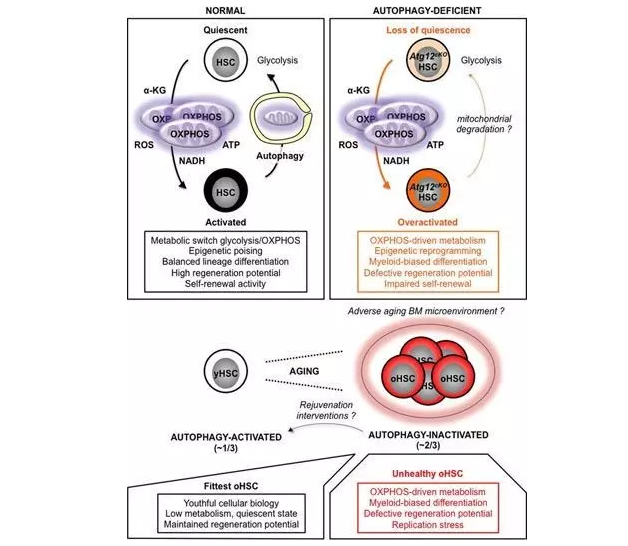
造血干细胞线粒体激活,代谢模式从糖酵解转变为氧化磷酸化,这样可以提供更多能量,并增加线粒体代谢产物,如α酮戊二酸,这种物质可以作为表观遗传酶底物和辅助因子发挥作用。造血干细胞必须进入休眠状态才能维持干细胞数量。自噬通过清除线粒体在驱动干细胞进入休眠状态十分关键,可以使氧化磷酸化转变为糖酵解代谢模式和休眠状态。自噬被阻断能造成造血干细胞处于氧化磷酸化代谢模式,导致表观遗传重编程和干细胞分化。衰老动物67%的造血干细胞无法激活自噬,结果处于氧化磷酸化代谢模式,表现为血液中性颗粒细胞增进等表型,另外33%的干细胞处于激活自噬,使老年动物骨髓内这些干细胞仍然保持休眠和年轻状态。通过刺激自噬,保持干细胞处于休眠状态将成为抗衰老的治疗新策略。
加州大学旧金山分校的研究人员发现了控制血液和免疫系统衰老的关键机制,这种机制就是自噬是成体干细胞维持活力的关键条件。这一发现有助于找到用来减缓或逆转与老化相关的慢性炎症疾病、贫血、血液癌症及危机生命的感染疾病的治疗方法。该研究结果已于3月9日在《自然》发表。
研究发现自噬过程不仅起到处理细胞废物的作用,对于维持造血干细胞造血功能也是必不可少的。造血干细胞是血液细胞的成体干细胞,具有长期自我更新能力和分化成各类成熟血细胞的潜能,如生产红细胞和血小板。
研究人员发现,自噬过程通过将具有代谢活性的造血干细胞转变为静息状态,从而实现对造血干细胞的监控检查,这种静息状态类似于冬眠。这种检查伴随着造血干细胞的生命活动将一直存在。
据高级科学家EmmanuellePassegué博士说,“自噬能诱导干细胞冬眠的生物学作用以前完全未知。”Passegué小组发现,自体吞噬过程未正常激活会对血液系统产生深远影响,能导致某些血细胞类型产生不平衡。将其移植到经照射的小鼠中时,类似于骨髓移植,自噬缺陷还降低造血干细胞再生整个血液系统的能力。研究还发现,老龄鼠体内70%造血干细胞未经历自噬过程,这些细胞表现出功能障碍特征。然而30%造血干细胞经历自噬过程,这些细胞的生物活性与新生造血干细胞相当。
Passegué指出:研究人员已经发现了多种组织特异性干细胞,这些干细胞的生理功能均随着细胞年龄的增加而下降。这是一个崭新地研究领域,是Passegué实验室小组近年来研究的重点。
第一作者TheodoreHo进行了大量实验和分析,比较了老龄鼠和年轻小鼠造血干细胞特征,所有小鼠的基因组均进行了编辑改造,不经历自噬过程。发现年轻小鼠中自噬缺陷能导致造血干细胞早衰。其造血干细胞外观和各种类型血细胞比例发生异常。
以前研究表明,自噬过程引起细胞内“囊”形成,可吞噬和消化生物分子和线粒体等细胞结构。但研究发现,基因程序性自噬缺失激发造血干细胞中DNA修饰。这些“表观遗传”DNA修饰改变了基因表达活性,改变了造血干细胞发展命运。这些修饰触发了某些血细胞不成比例的产生,并降低了造血干细胞在移植时再生整个血液系统的能力。表现出高频自噬过程的少数老造血干细胞能够保持他们的线粒体活性和代谢活动检查,并且可以在移植后重建一个健康的血液系统,类似于年轻小鼠。这一发现可能提供一个有趣的治疗方法,用于重新激活所有老化造血干细胞的自噬过程,减慢血液系统的老化。希望能找到一种方法真正改善干细胞,通过预防血癌发展以及提供更好的免疫系统,从而利用这种方法造福老年人。
下一条:干细胞给肝病患者带来福音


