白血病干细胞最新研究进展
2017年8月29日/生物谷BIOON/---白血病是一类造血干细胞恶性克隆性疾病。克隆性白血病细胞因为增殖失控、分化障碍、凋亡受阻等机制在骨髓和其他造血组织中大量增殖累积,并浸润其他组织和器官,同时正常造血受抑制。临床可见不同程度的贫血、出血、感染发热以及肝、脾、淋巴结肿大和骨骼疼痛。据报道,我国各地区白血病的发病率在各种肿瘤中占第六位。按起病的缓急可分为急、慢性白血病。急性白血病细胞分化停滞在早期阶段,以原始及早幼细胞为主,疾病发展迅速,病程数月。慢性白血病细胞分化较好,以幼稚或成熟细胞为主,发展缓慢,病程数年。在过去15年多以来,越来越多的科学家发现不同类型的白血病中存在白血病干细胞,而且发现白血病干细胞是白血病发作和难以治疗的根源。为此,小编针对过去15年多以来这方面的研究进展,针对白血病干细胞进行一番详细盘点,希望有助于大家。1.Cell:重大进展!维生素C可促进白血病干细胞死亡,有望用于治疗白血病doi:10.1016/j.cell.2017.07.032
 在一项新的研究中,来自加拿 大大学健康网络(University Health Network, UHN)玛嘉烈公主癌症中心的白血病研究人员开发出一种源自白血病干细胞的17基因标志(17-gene signature),从而能够在诊断时预测急性髓系白血病(acute myeloid leukemia, AML)病人是否将对标准治疗作出反应。相关研究结果于2016年12月7日在线发表在Nature期刊上。这种新的生物标志物被命名为LSC17评分(LSC17 score,白血病干细胞17基因标志评分),这是因为它来自促进疾病产生和复发的白血病干细胞。这些休眠的干细胞具有允许让它们抵抗标准化疗的性质,其中化疗被设计用于击败快速分裂的癌细胞。尽管在治疗后病情获得缓解,但是这些干细胞的持续存在是病人癌症复发的原因。AML是最为致命性的白血病类型之一,也是成年人最为常见的白血病类型;随着我们年龄增加,它的发病率会增加。4.科学家揭示白血病重要发病机制并找到潜在靶点doi:10.1038/leu.2016.339在一项新研究中,来自美国贝勒医学院的研究人员发现编码转录因子KLF4的基因表达在T-ALL患病儿童体内因DNA甲基化而受到抑制。他们在小鼠模型中观察到KLF4缺失会加速NOTCH1诱导T-ALL的发生,增强白血病细胞从G1期到S期的转换,促进白血病干细胞的扩增。相关研究结果发表在国际学术期刊Leukemia上。通过对机制进行研究,研究人员发现KLF4能够抑制激酶MAP2K7的表达,在小鼠模型和T-ALL患病儿童体内,KLF4缺失会导致MAP2K7以及下游效应因子JNK和ATF2的激活。除此之外研究人员还开发了一种靶向治疗策略,他们发现JNK抑制剂可以抑制细胞 来源以及病人 来源肿瘤异种移植模型体内白血病细胞的扩增。总得来说,这些数据揭示了KLF4在调节T-ALL细胞内MAP2K7信号途径方面的新功能,靶向该途径或可清除T-ALL病人体内的白血病干细胞。5.Cell:40年来,首次提出AML白血病治疗新药物doi:10.1016/j.cell.2016.08.057在一项新的研究中,来自美国麻省总医院和哈佛干细胞研究所的研究人员鉴定出一种药物化合物可阻止小鼠体内的急性髓性白血病(acute myeloid leukemia, AML)发展,其中AML是一种骨髓癌症,而且人们在过去40年的时间内未开发出针对这种癌症的新药物。相关研究结果于2016年9月15日在线发表在Cell期刊上,论文标题为“Inhibition of Dihydroorotate Dehydrogenase Overcomes Differentiation Blockade in Acute Myeloid Leukemia”。论文通信作者为麻省总医院再生医学中心副主任David Sykes和主任David Scadden。作为Scadden实验室的一名博士后研究员,Sykes对小鼠造血祖细胞进行基因改造,这样当它们成熟时,它们会发生绿光。通过与哈佛大学布罗德研究所和麻省理工学院合作,Scadden团队对330,000种化学物进行功能性筛查,结果发现12种化合物能够让这些细胞发出绿光,这表明这些化合物促进这些细胞分化。在这12种化合物中,11种物质阻断一种被称作DHODH的代谢酶,有效地迫使这些细胞进入一种研究人员称之为禁食期(period of fasting)的状态。在利用一种已知的DHODH抑制剂进行治疗10周后,AML小鼠和携带人白血病细胞的小鼠体重增加,比较活跃,含有更少的白血病干细胞,而且存活更长时间,这表明发生一种有意义的病情缓解。显著地,没有一只小鼠在治疗后发生病情恶化。研究人员希望在一项临床试验中对这种抑制剂进行测试。6.JCI:中山大学科学家找到可能彻底治愈常见白血病的新靶点doi:10.1172/JCI85239
在一项新的研究中,来自加拿 大大学健康网络(University Health Network, UHN)玛嘉烈公主癌症中心的白血病研究人员开发出一种源自白血病干细胞的17基因标志(17-gene signature),从而能够在诊断时预测急性髓系白血病(acute myeloid leukemia, AML)病人是否将对标准治疗作出反应。相关研究结果于2016年12月7日在线发表在Nature期刊上。这种新的生物标志物被命名为LSC17评分(LSC17 score,白血病干细胞17基因标志评分),这是因为它来自促进疾病产生和复发的白血病干细胞。这些休眠的干细胞具有允许让它们抵抗标准化疗的性质,其中化疗被设计用于击败快速分裂的癌细胞。尽管在治疗后病情获得缓解,但是这些干细胞的持续存在是病人癌症复发的原因。AML是最为致命性的白血病类型之一,也是成年人最为常见的白血病类型;随着我们年龄增加,它的发病率会增加。4.科学家揭示白血病重要发病机制并找到潜在靶点doi:10.1038/leu.2016.339在一项新研究中,来自美国贝勒医学院的研究人员发现编码转录因子KLF4的基因表达在T-ALL患病儿童体内因DNA甲基化而受到抑制。他们在小鼠模型中观察到KLF4缺失会加速NOTCH1诱导T-ALL的发生,增强白血病细胞从G1期到S期的转换,促进白血病干细胞的扩增。相关研究结果发表在国际学术期刊Leukemia上。通过对机制进行研究,研究人员发现KLF4能够抑制激酶MAP2K7的表达,在小鼠模型和T-ALL患病儿童体内,KLF4缺失会导致MAP2K7以及下游效应因子JNK和ATF2的激活。除此之外研究人员还开发了一种靶向治疗策略,他们发现JNK抑制剂可以抑制细胞 来源以及病人 来源肿瘤异种移植模型体内白血病细胞的扩增。总得来说,这些数据揭示了KLF4在调节T-ALL细胞内MAP2K7信号途径方面的新功能,靶向该途径或可清除T-ALL病人体内的白血病干细胞。5.Cell:40年来,首次提出AML白血病治疗新药物doi:10.1016/j.cell.2016.08.057在一项新的研究中,来自美国麻省总医院和哈佛干细胞研究所的研究人员鉴定出一种药物化合物可阻止小鼠体内的急性髓性白血病(acute myeloid leukemia, AML)发展,其中AML是一种骨髓癌症,而且人们在过去40年的时间内未开发出针对这种癌症的新药物。相关研究结果于2016年9月15日在线发表在Cell期刊上,论文标题为“Inhibition of Dihydroorotate Dehydrogenase Overcomes Differentiation Blockade in Acute Myeloid Leukemia”。论文通信作者为麻省总医院再生医学中心副主任David Sykes和主任David Scadden。作为Scadden实验室的一名博士后研究员,Sykes对小鼠造血祖细胞进行基因改造,这样当它们成熟时,它们会发生绿光。通过与哈佛大学布罗德研究所和麻省理工学院合作,Scadden团队对330,000种化学物进行功能性筛查,结果发现12种化合物能够让这些细胞发出绿光,这表明这些化合物促进这些细胞分化。在这12种化合物中,11种物质阻断一种被称作DHODH的代谢酶,有效地迫使这些细胞进入一种研究人员称之为禁食期(period of fasting)的状态。在利用一种已知的DHODH抑制剂进行治疗10周后,AML小鼠和携带人白血病细胞的小鼠体重增加,比较活跃,含有更少的白血病干细胞,而且存活更长时间,这表明发生一种有意义的病情缓解。显著地,没有一只小鼠在治疗后发生病情恶化。研究人员希望在一项临床试验中对这种抑制剂进行测试。6.JCI:中山大学科学家找到可能彻底治愈常见白血病的新靶点doi:10.1172/JCI85239
 近日,来自中国中山大学的潘景轩教授带领研究团队在慢性髓性白血病(CML)的治疗靶点开发方面取得重要进展,他们发现甲基转移酶PRMT5是维持白血病干细胞存活和自我更新的重要因子,该研究成果有望推动对CML彻底治愈的进程。在这项研究中,研究人员在CML细胞中发现BCR-ABL和蛋白质精氨酸甲基转移酶5(PRMT5)之间存在一个正反馈回路。他们观察到人类CML白血病干细胞中存在PRMT5过表达的现象。之后研究人员利用shRNA对PRMT5的基因表达进行沉默,也利用小分子抑制剂PJ-68阻断PRMT5的甲基转移酶活性,均发现能够降低来自CML病人的白血病干细胞的存活,抑制长期培养起始细胞。更进一步的研究表明,降低PRMT5表达或用抑制剂抑制其活性能够显著延长CML小鼠模型的生存时间,损伤移植到体内的CML白血病干细胞在体内的自我更新能力。除此之外PJ-68还会抑制人类CML CD34+细胞在免疫缺陷小鼠体内的长期移植效果。研究人员还发现抑制PRMT5能够通过减少DVL3蛋白干扰Wnt/b-catenin信号途径在CML CD34+细胞中的作用。7.Cancer Discov:英国女科学家Nature之后再发白血病治疗重磅研究doi:10.1158/2159-8290.CD-16-0263最近来自英国格拉斯哥大学的科学家们在慢性髓系白血病治疗方面又取得重大进展,他们找到新的药物组合可以杀死超过90%的慢性髓系白血病干细胞。相关研究结果发表在国际学术期刊Cancer Discovery上。格拉斯哥大学的研究人员一直在寻找杀死慢性髓系白血病干细胞的方法,最近他们发现了一种新药物有望通过杀死慢性髓系白血病干细胞彻底治愈慢性髓系白血病,研究人员表示这种药物通过抑制EZH2的活性发挥作用。之前有研究证明EZH2能够促进多种癌细胞的存活,但是在慢性髓系白血病中没有得到研究。文章第一作者Mary Scott表示:“我们的目标是将这种药物推向临床试验,对慢性髓系白血病病人进行治疗。目前使用EZH2抑制剂治疗其他血液癌症的临床试验已经得到一些初步结果。这种药片形式的药物非常安全同时副作用很小,非常适于慢性髓系白血病的临床治疗。”文章作者Tessa Holyoake教授曾在今年6月份的Nature杂志上发表一项研究成果,报道了一个完全不同的药物组合可以高度有效地靶向慢性髓系白血病干细胞。8.Blood:靶向白血病干细胞才是治疗白血病的关键doi:10.1182/blood-2016-02-695312
近日,来自中国中山大学的潘景轩教授带领研究团队在慢性髓性白血病(CML)的治疗靶点开发方面取得重要进展,他们发现甲基转移酶PRMT5是维持白血病干细胞存活和自我更新的重要因子,该研究成果有望推动对CML彻底治愈的进程。在这项研究中,研究人员在CML细胞中发现BCR-ABL和蛋白质精氨酸甲基转移酶5(PRMT5)之间存在一个正反馈回路。他们观察到人类CML白血病干细胞中存在PRMT5过表达的现象。之后研究人员利用shRNA对PRMT5的基因表达进行沉默,也利用小分子抑制剂PJ-68阻断PRMT5的甲基转移酶活性,均发现能够降低来自CML病人的白血病干细胞的存活,抑制长期培养起始细胞。更进一步的研究表明,降低PRMT5表达或用抑制剂抑制其活性能够显著延长CML小鼠模型的生存时间,损伤移植到体内的CML白血病干细胞在体内的自我更新能力。除此之外PJ-68还会抑制人类CML CD34+细胞在免疫缺陷小鼠体内的长期移植效果。研究人员还发现抑制PRMT5能够通过减少DVL3蛋白干扰Wnt/b-catenin信号途径在CML CD34+细胞中的作用。7.Cancer Discov:英国女科学家Nature之后再发白血病治疗重磅研究doi:10.1158/2159-8290.CD-16-0263最近来自英国格拉斯哥大学的科学家们在慢性髓系白血病治疗方面又取得重大进展,他们找到新的药物组合可以杀死超过90%的慢性髓系白血病干细胞。相关研究结果发表在国际学术期刊Cancer Discovery上。格拉斯哥大学的研究人员一直在寻找杀死慢性髓系白血病干细胞的方法,最近他们发现了一种新药物有望通过杀死慢性髓系白血病干细胞彻底治愈慢性髓系白血病,研究人员表示这种药物通过抑制EZH2的活性发挥作用。之前有研究证明EZH2能够促进多种癌细胞的存活,但是在慢性髓系白血病中没有得到研究。文章第一作者Mary Scott表示:“我们的目标是将这种药物推向临床试验,对慢性髓系白血病病人进行治疗。目前使用EZH2抑制剂治疗其他血液癌症的临床试验已经得到一些初步结果。这种药片形式的药物非常安全同时副作用很小,非常适于慢性髓系白血病的临床治疗。”文章作者Tessa Holyoake教授曾在今年6月份的Nature杂志上发表一项研究成果,报道了一个完全不同的药物组合可以高度有效地靶向慢性髓系白血病干细胞。8.Blood:靶向白血病干细胞才是治疗白血病的关键doi:10.1182/blood-2016-02-695312
 罗切斯特大学医学中心的研究人员最近发表了一项研究成果,他们证明了为何白血病如此难以治疗,并且提示目前的药物开发方法应当进行调整靶向更多基因或信号通路。相关研究结果发表在国际学术期刊Blood上。这项研究首次在一个较长的时间段内检测了白血病干细胞如何变化,并首次在对应不同时间节点的样品中同时分析了一些已知的生物标记物。“虽然过去几年里科学家们作出了许多努力,开发新药来靶向CD33,CD123以及CD47等表达在急性白血病细胞上的蛋白,但是该研究仍然给未来的治疗开发提了一个醒。目前下一代免疫治疗也只是靶向一些特定的蛋白。但是为了实现对疾病的长期缓解甚至治愈,我们的研究发现认为现在的药物开发方向存在问题。”文章作者这样说道。领导该研究的研究人员在病人诊断初期,治疗过程中收集了白血病干细胞样本,如果病人出现复发再次进行收集。研究人员使用了一种将干细胞群体进行分离的方法,然后进行分析。随后他们对比了许多蛋白标记物的表达变化,寻找了白血病干细胞扩张数量的迹象。这些新发表的数据来自25名病人,数据表明在诊断和复发时期白血病干细胞池增加了9到90倍。干细胞池的扩张可能导致疾病抵抗治疗,因此科学家更加理解了为何这种疾病复发之后病人几乎无法继续生存。
罗切斯特大学医学中心的研究人员最近发表了一项研究成果,他们证明了为何白血病如此难以治疗,并且提示目前的药物开发方法应当进行调整靶向更多基因或信号通路。相关研究结果发表在国际学术期刊Blood上。这项研究首次在一个较长的时间段内检测了白血病干细胞如何变化,并首次在对应不同时间节点的样品中同时分析了一些已知的生物标记物。“虽然过去几年里科学家们作出了许多努力,开发新药来靶向CD33,CD123以及CD47等表达在急性白血病细胞上的蛋白,但是该研究仍然给未来的治疗开发提了一个醒。目前下一代免疫治疗也只是靶向一些特定的蛋白。但是为了实现对疾病的长期缓解甚至治愈,我们的研究发现认为现在的药物开发方向存在问题。”文章作者这样说道。领导该研究的研究人员在病人诊断初期,治疗过程中收集了白血病干细胞样本,如果病人出现复发再次进行收集。研究人员使用了一种将干细胞群体进行分离的方法,然后进行分析。随后他们对比了许多蛋白标记物的表达变化,寻找了白血病干细胞扩张数量的迹象。这些新发表的数据来自25名病人,数据表明在诊断和复发时期白血病干细胞池增加了9到90倍。干细胞池的扩张可能导致疾病抵抗治疗,因此科学家更加理解了为何这种疾病复发之后病人几乎无法继续生存。

图片来自Cell, doi:10.1016/j.cell.2017.07.032
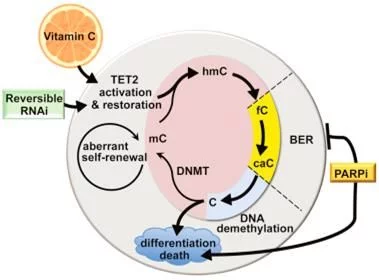
在一项新的研究中,来自美国纽约大学医学院等研究机构的研究人员发现维生素C不会导致骨髓中存在缺陷的造血干细胞(即白血病干细胞)发生增殖形成血癌,而是促使它们发生分化和凋亡。相关研究结果于2017年8月17日在线发表在Cell期刊上,论文标题为“Restoration of TET2 Function Blocks Aberrant Self-Renewal and Leukemia Progression”。这些研究人员说,在某些白血病患者中,已知某些基因变化会降低酶TET2促进白血病干细胞分化为成熟的最终会死亡的血细胞的能力。这项新的研究发现维生素C在经过基因改造缺失TET2的小鼠中可激活TET2的功能。论文共同通信作者Benjamin G. Neel说,“我们对高剂量的维生素C可能安全地治疗由TET2缺失性的白血病干细胞导致的血液疾病的前景感到激动人心,而且很可能是与其他的靶向疗法联合使用。”在10%的急性髓性白血病(AML)患者中存在降低TET2功能的基因突变,在30%的骨髓增生异常综合症中存在TET2基因突变,在将近50%的慢性骨髓单核细胞性白血病中存在TET2基因突变。2.Nature:重磅!新研究揭示出AML白血病复发之谜doi:10.1038/nature22993在一项新的研究中,来自加拿大学健康网络(University Health Network)和多伦多大学等研究机构的研究人员将急性髓细胞性白血病(Acute myeloid leukemia, AML)复发的起源追踪到稀少的治疗抵抗性的白血病干细胞,这些白血病干细胞在疾病确诊时尚未开始化疗之前就已存在于体内。针对这种侵袭性的癌症,他们也从发生疾病复发的不同患者体内鉴定出两种不同的干细胞样(stem-cell like)细胞群体。在此之前,他们已证实这种侵袭性癌症是由骨髓中的造血干细胞开始产生的。这些发现对导致这种疾病复发的干细胞类型提供重要的见解,并且能够有助加快寻找新的前期疗法。相关研究结果于2017年6月28日在线发表在Nature期刊上,论文标题为“Tracing the origins of relapse in acute myeloid leukaemia to stem cells”。论文通信作者为大学健康网络玛嘉烈公主癌症中心高级研究员、多伦多大学分子遗传学系教授John Dick博士。论文第一作者为博士后研究员Liran Shlush博士和科研副助理Amanda Mitchell博士。Dick博士说,“首先,我们想知道这些血液样品之间存在的类似性和差异。我们开展详细的遗传学研究,并且利用全基因组测序研究了确诊时的DNA的每个部分和疾病复发时的DNA的每个部分。接着,我们研究了遗传变化在哪些细胞中发生。”这种两部分方法捕获到仅在疾病复发时观察到的一组突变,这使得这些研究人员能够利用几年前在Dick实验室开发出的工具对白血病干细胞和正常的干细胞进行筛选和分类,从而将注意力集中于导致疾病复发的特定干细胞类型上。3.Nature:利用白血病干细胞LSC17评分可预测AML病人治疗反应doi:10.1038/nature20598



下一条:利用供体干细胞治疗脊髓神经损伤


