汉氏联合成果专栏25:探索干细胞外泌体的疾病治疗作用
大家知道,干细胞具有神奇的再生功能,对许多难治性疾病具有良好的治疗作用。
然而,大家可能不知道的是,干细胞分泌的活性物质也都是宝。例如,间充质干细胞分泌的细胞外囊泡和外泌体,都具有疾病治疗作用。
外泌体是指包含了复杂RNA和蛋白质的小膜泡 (30-150nm),其中包含大量活性物质。
细胞外囊泡(EVs)是细胞主动释放的纳米级膜囊泡,主要包括外泌体和微泡。
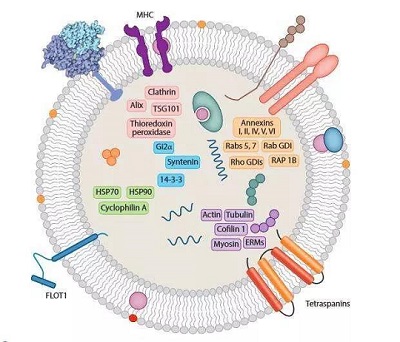
(图|外泌体)
由于干细胞的制备、运输、保存都需要很严苛的条件,而外泌体和细胞外囊泡的活性更稳定,也更容易保存。因此,外泌体和细胞外囊泡已经成为科学研究的热点,也是干细胞衍生产品开发的新方向。
汉氏联合研发团队很早就意识到这一趋势,在外泌体和细胞外囊泡的治疗作用方面做了大量研究工作,并发表了系列国际论文。
为了便于大家了解到干细胞外泌体和细胞外囊泡领域的最新研究进展和未来的应用前景,在此将汉氏联合研发团队完成的相关成果作一介绍。
1、神奇的“一氧化氮”气体增强干细胞外泌体的功能
论文题目:Enhanced proangiogenic potential of mesenchymal stem cell-derived exosomes stimulated by a nitric oxide releasing polymer(一氧化氮增强间充质干细胞外泌体的促血管生成能力)

有研究发现,间充质干细胞外泌体具有促进血管新生的功能。
那么,有没有什么方式能够更进一步增强外泌体的促血管新生功能,从而进一步提升对缺血性疾病的治疗效果?
有,那就是神奇的气体---一氧化氮。
在本研究中,汉氏联合研发团队设计了一种能够自动释放一氧化氮的多聚物。 将这一多聚物加入胎盘间充质干细胞的培养体系后,多聚物释放的一氧化氮能够刺激外泌体的释放。这些被一氧化氮刺激后释放的外泌体能够显著增强人脐静脉内皮细胞的血管生成作用。此外,在小鼠后肢缺血模型中,经一氧化氮刺激释放的外泌体显示出更好的促血管生成作用,能够明显改善肢体功能。
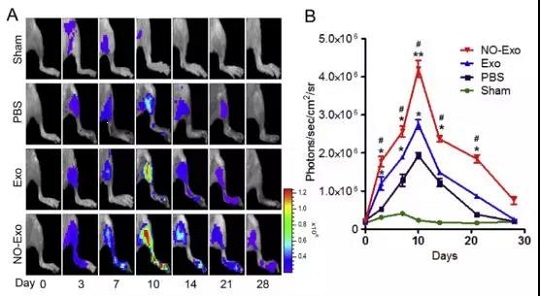
一氧化氮刺激释放的外泌体对小鼠后肢缺血的治疗作用更强大
进一步的分析表明,一氧化氮刺激后胎盘间充质干细胞释放的外泌体中富含VEGF和miR-126,它们可能是导致外泌体促进血管生成能力增强的原因。
汉氏联合研发团队的这一研究表明,在胎盘间充质干细胞培养微环境中加入能够释放一氧化氮的多聚物,有助于开发促血管新生能力更强的外泌体,未来用于缺血性疾病的治疗。
2、间充质干细胞外泌体能够增强化疗药对白血病的治疗效果
论文题目:Exosomes from mesenchymal stromal cells enhance imatinib-induced apoptosis in human leukemia cells via activation of caspase signaling pathway(间充质间质细胞外泌体通过激活caspase信号通路,增强伊马替尼诱导白血病细胞凋亡的作用)

《我不是药神》这部电影相信大家都看过,其中的一个治疗白血病的神药叫"格列卫",是治疗慢性粒细胞白血病的靶向药物。
大家也许不知道的是,格列卫的化学名叫伊马替尼。它并没有大家想的那么神,只对大约70%的慢性粒细胞白血病患者有效,耐药性是其药效减低的重要原因。
因此,伊马替尼的耐药性在慢性粒细胞白血病治疗中是一个不得不面对的挑战。
汉氏联合研发团队的研究发现,脐带间充质干细胞外泌体本身对慢性粒细胞白血病细胞株K562细胞的存活和凋亡(凋亡,即程序性细胞死亡,"凋"取自树叶凋零的隐喻)无明显影响。然而,脐带间充质干细胞外泌体能够加强伊马替尼对K562细胞的毒性作用,包括抑制活力和促进凋亡。
脐带间充质干细胞外泌体的作用机制是增强了伊马替尼诱导的Bax蛋白(一种促进细胞凋亡的信号蛋白)表达增加和Bcl-2蛋白(一种抑制细胞凋亡的信号蛋白)表达减少。另外,脐带间充质干细胞外泌体联合伊马替尼可进一步激活K562细胞的细胞内激酶caspase-9和caspase-3,它们都是促进肿瘤细胞凋亡的信号蛋白。
这些结果表明,人脐带间充质干细胞分泌的外泌体能够降低K562细胞对伊马替尼的耐药性,增强其敏感性,进而有望改进治疗效果。因此,伊马替尼与脐带间充质干细胞外泌体联合应用有望成为提高慢性粒细胞白血病疗效的一种有效途径。
3、间充质干细胞外泌体与水凝胶结合,治疗作用更强大
论文题目:Enhanced Therapeutic Effects of Mesenchymal Stem Cell-Derived Exosomes with an Injectable Hydrogel for Hindlimb Ischemia Treatment(可注射用水凝胶增强间充质干细胞外泌体对下肢缺血的治疗作用)

虽然干细胞外泌体的疾病治疗作用越来越受到重视,但是在临床应用中,如何维持外泌体在体内的长期活性和稳定性,仍是一个重要的挑战。
我们知道,物质通常在温度高时倾向于变化为液态或气态,在温度低时倾向于变为固态。科学家开发了一种神奇的生物材料,特性与我们的常识正好相反:温度低时为液态,在温度逐渐升高时会转变为固态。水凝胶就是这样一种神奇的生物材料,它在4°C时为液体,在37°C时为固态。

水凝胶在4°C时为液体,在37°C时其中的分子就相互交联为固态
汉氏联合研发团队利用水凝胶的这一独特属性,在4°C液态时与人胎盘间充质干细胞分泌的外泌体充分混合(外泌体水凝胶),然后注射入体内。由于身体温度是37°C,外泌体水凝胶会变为固态,外泌体就可以被稳定在病变部位发挥治疗作用。
汉氏联合研发团队的研究数据表明,除了发挥固定作用,提高靶向治疗的效果,水凝胶可以增强外泌体的稳定性和活性,对血管内皮细胞具有保护作用,并能够促进血管生成,增强小鼠下肢缺血的治疗效果。
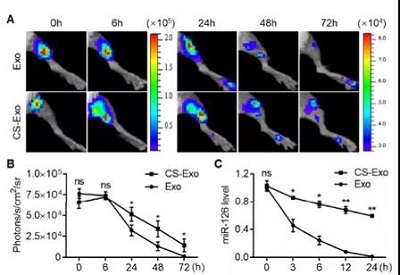
外泌体水凝胶对小鼠后肢缺血的治疗作用更强大
汉氏联合团队利用水凝胶大大增强干细胞外泌体的治疗效果,为未来干细胞衍生品的产业化开发提供了思路。
4、间充质干细胞分泌的细胞外囊泡能够保护血管,预防血管栓塞和钙化
论文题目:MSC-derived sEVs enhance patency and inhibit calcification of synthetic vascular grafts by immunomodulation in a rat model of hyperlipidemia(间充质干细胞来源的细胞外囊泡能够抑制高血脂大鼠体内移植血管的钙化)

由于患者体内病理环境的影响,移植入患者体内的血管容易发生钙化而再次发生堵塞。间充质干细胞分泌的细胞外囊泡中包含大量活性分子,如微小RNA和细胞因子,具有改善血管功能的作用,有预防血管堵塞的潜能。
在本研究中,汉氏联合研发团队开发了一种经细胞外囊泡功能化处理的血管移植物,并在患有高脂血症的大鼠体内进行了功能评价。 首先,研发团队用肝素处理血管移植物,以增强其抗凝血能力。然后,将间充质干细胞分泌的细胞外囊泡加载到血管移植物上,获得功能性血管移植物。
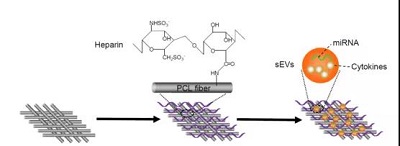
细胞外囊泡功能化处理血管移植物的过程
将血管移植物植入大鼠体内,替代一段大鼠腹腔内的一段动脉(约1 厘米长)。
结果表明,间充质干细胞分泌的细胞外囊泡能够有效抑制血管内血栓形成和钙化,提高血管移植物的通畅性。而且,研发人员还发现,细胞外囊泡内的生物活性分子,如血管内皮生长因子(VEGF)、miRNA126、miRNA145等,能够显著促进血管内皮细胞和血管平滑肌细胞的再生。更重要的是,间充质干细胞分泌的细胞外囊泡显示出强大的免疫调节作用,能够诱导巨噬细胞从促炎和导致动脉粥样硬化的M1表型向抗炎和抗动脉硬化的M2表型转变。
总之,研发团队的结果表明,间充质干细胞分泌的细胞外囊泡能够有效预防血管钙化和栓塞,显著提升血管性能,在心血管疾病治疗中具有重要意义。
结语
以上成果主要由汉氏联合干细胞研究院副院长,北京经济技术开发区领军人才,李宗金教授带领研发团队完成,代表了干细胞领域内的领先研究水平。
汉氏联合研发团队的目标是将所开发的外泌体和细胞外囊泡产品获得药监局的批准并上市,服务广大患者。相信这一目标在不久的未来会变为现实。


