【细胞科技专栏】NK细胞筑牢对抗HPV的“第一道防线”
供稿机构:汉氏联合高等研究院南开大学博士后工作站
作者:杨思俊博士
前言
在女性常见的恶性肿瘤中,宫颈癌的发病率仅次于乳腺癌,大多数宫颈癌是由HPV感染所致。全球每年新发病例近60万,死亡约30万。中国每年新增病例约13.5万,其中8万人因此死亡。考虑到HPV感染的普遍性和致癌性,对HPV感染的治疗值得高度重视。
HPV(人乳头瘤病毒)是一种来自乳头瘤病毒科的DNA 病毒。许多 HPV 感染不会引起任何症状,90% 会在两年内自行消退。然而,在某些情况下,HPV 感染持续存在并导致疣或癌前病变。根据受影响的部位,这些病变会增加宫颈癌、外阴癌、阴道癌、阴茎癌、肛门癌、口咽癌、扁桃体癌的风险。
HPV有200多种基因型,分为高危型和低危型病毒,HPV16和HPV18两种毒株占宫颈癌病例的 70%。HPV16占据几乎90%的HPV阳性口咽癌。另外,HPV6和HPV11是生殖器疣和喉乳头状瘤病的常见原因。
在生命的某个阶段,几乎每个人都会感染HPV,3%-5%的感染人群会由感染转变为肿瘤。人类历史上可以预防肿瘤的疫苗只有两个,HBV(乙肝病毒)疫苗和HPV疫苗。预防接种HPV疫苗,是预防青春期免疫妇女宫颈癌的有效方法。
那么,还有很多未接种疫苗的感染者,我们该如何治疗?
从文献调研的情况看,我们发现NK细胞是先天免疫系统的重要屏障和关键组成部分,这些细胞具有通过两种机制识别和杀死HPV病毒感染和转化的细胞:颗粒依赖性细胞毒性以及靶细胞的凋亡途径。在已经感染HPV病毒的个体中,NK细胞在天然免疫中能否发挥清除病毒的作用是我们关注的焦点,因此,本文综述了NK细胞与HPV相关研究进展,供参考。
以NK为核心的先天免疫的抗病毒模式图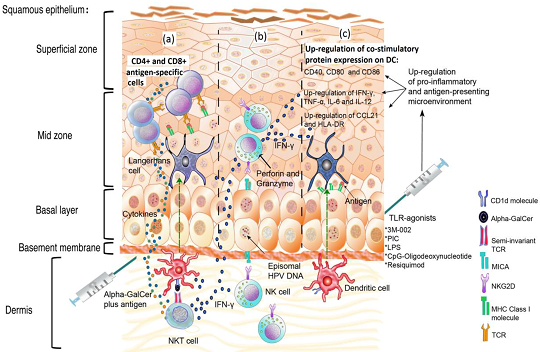
图注:HPV 感染期间辅助刺激后先天免疫反应作用的示意图。
(a)使用 α-GalCer 和 HPV 抗原刺激自然杀伤 T (NKT) 细胞,促进 CD4+ 和 CD8+ T 细胞抗原特异性反应以及高水平炎症细胞因子(如 IFN-γ)的快速释放。
(b)NK细胞可以通过IFN-γ通过诸如α-GalCer和Toll样受体(TLR)激动剂的佐剂间接激活后杀死HPV感染的细胞。
(c)通过 TLR 激动剂诱导促炎反应从 HPV 诱导的微环境中拯救角质形成细胞以促进抗原呈递。
HPV感染影响NK细胞的活性
NK 细胞活性主要通过抑制受体和激活受体之间的平衡受到严格调节。然而,这些受体的失调在HPV 感染中很常见。在宫颈癌患者的 NK 细胞中发现 NKp30 和 NKp46 受体水平较低,这与 NK 细胞的低细胞毒活性有关[1, 2]。NK 细胞中另一个与细胞毒性相关的重要受体是 NKG2D。该受体通过与主要组织相容性复合体 I 类相关链 A (MICA) 蛋白的相互作用参与NK细胞介导细胞裂解作用。NKG2D 和 MICA 在存在 HPV 感染的情况下都受到调节[3, 4]。此外,血清中游离 MICA 的水平与宫颈癌进展相关,这表明导致 HPV 持续存在或肿瘤进展的一个重要因素可能是血清中可溶性 MICA 的存在。在 NK 细胞系 (NKL) 中,发现当 NKL 与宫颈癌细胞系 HeLa、SiHa 或 C33A 共培养时,NKG2D 受体被下调,但非致瘤性永生化角质形成细胞 HaCaT 不存在。在与 HPV 阳性癌细胞系(HeLa、SiHa)接触后,NK细胞系中 NKG2D 的这种下调与NK细胞毒性活性降低有关,但与 HPV 阴性细胞系 C33 或非致瘤性 HaCat 细胞接触后则不行。
综合以上几篇文献报道,我们发现无论是在HPV感染宫颈癌患者或者细胞系实验中,我们均发现NK细胞的活性均不同程度的被抑制,而这个抑制作用主要通过下调NK细胞的表面受体(NKp30 、NKp46、NKG2D)活性来实现。因此,我们认为,HPV持续的感染后抑制NK细胞的抗肿瘤效应是肿瘤发生的重要因素之一。
对HPV感染细胞的杀伤作用
如果HPV的感染会抑制NK细胞的活性,那么解除NK的抑制作用,是否会激活NK细胞的活性呢?
有限的文献报道中,我们发现,某些药物能够降低 MICA 血浆水平,允许 NK 细胞攻击表达 MICA 的细胞。例如,肼苯哒嗪和丙戊酸盐的给药可以增加CaSki宫颈癌细胞系中MICA和MICB配体的表达并减少它们向上清液的脱落,从而允许NK攻击;而不含肼苯哒嗪和丙戊酸盐的细胞不易受到 NK 攻击[5]。HPV还可以通过改变免疫抑制酶吲哚胺-2,3-双加氧酶(IDO)来逃避NK细胞的细胞毒机制,IDO的表达与肿瘤细胞逃避免疫监视有关。IDO 的缺失与 NK 细胞活性增加有关。例如,用靶向 IDO 基因 (shIDO) 的短发夹 RNA (shRNA) 质粒转染的 CaSki 细胞比对照细胞 (CaSki/Mock)在体外更容易受到 NK 细胞攻击。此外,体内在 BALB/c 裸鼠中进行的检测显示,与对照皮下肿瘤相比,CaSki/shIDO 形成的肿瘤的基质中 NK 细胞的积累更多。并且,低水平的 IDO 增加了宫颈癌细胞对 NK 细胞的易感性,表明 IDO 靶向 shRNA 干扰序列可以解除NK的抑制,有助于宫颈癌的靶向治疗[6]。
尽管 HPV 为逃逸 NK 细胞杀伤而采用的一些机制是已知的,但 NK 细胞在病毒感染自然史中的作用还在研究,例如当前的新冠病毒。此外,有研究探讨佐剂或药物在感染早期可能增加 NK 细胞数量及其对 HPV 感染细胞的细胞毒活性或在后期对 HPV 阳性肿瘤细胞的作用。如模式图中所示,一些佐剂可能通过IFN-γ间接激活NK细胞。
另外,最有意思的报道是,目前可用的 Gardasil HPV 疫苗可以增加免疫后 NK 细胞的数量,这与 NK 细胞中 NKG2D、NKp30、Nkp46 和 ILT2 受体的表达增加有关,表明除了中和抗体的增加外,还有NK细胞也参与了抗病毒过程,提高了疫苗有效性[7]。这提示我们,在针对HPV感染的治疗方法中,除了疫苗接种产生的抗体外,NK细胞的作用不可忽视。从机制的角度分析,抗体仅仅是中和病毒,然而针对已经感染HPV病毒的细胞的清除仍然是需要NK细胞介导的毒性作用来完成。因此我们强烈建议,在针对HPV感染的治疗中,要分情况实施方案,未感染过HPV的患者,疫苗的接种可作为预防措施,同时辅助NK细胞的输注提高疫苗的有效率,而通过体检筛查发现已经感染HPV的患者,NK的输注可以成为主要的治疗方案。
临床案例
BVAC-C是一种以人乳头瘤病毒(HPV)16/18E6/E7基因转染的B细胞和单核细胞(NK细胞其中之一)为基础的免疫治疗性疫苗,负载有α-半乳糖基神经酰胺。这项I期研究试图确定BVAC-C在铂类耐药复发宫颈癌患者中的耐受性和免疫原性。研究对象为HPV16阳性或18阳性复发性或持续性宫颈癌患者,这些患者之前至少接受过一次铂类联合化疗。BVAC-C每4周静脉注射3次,剂量递增按1×10^7、4×10^7或1×10^8个细胞/剂量的3人队列设计进行。11名患者入选,其中6名(55%)患者在入选前接受了两次或两次以上的铂类化疗。观察21个周期的治疗相关不良事件(TRAE)。TRAE多为轻度发热(n=6,55%)或肌痛(n=4,36%)。未发生剂量限制毒性。5例(56%)患者病情稳定4.2~11个月,总体疗效最佳。所有患者的中位无进展生存期为6.8个月(95%CI,3.2~无限个月),6个月和12个月的总生存率分别为89%(95%CI,71~100%)和65%(95%CI,39~100%)。
BVAC-C在所有患者接种疫苗后均能诱导自然杀伤T细胞(NKT细胞)、自然杀伤细胞(NK细胞)和HPV16/18E6/E7特异性T细胞的活化。BVAC-C耐受性良好,在HPV16阳性或18阳性复发宫颈癌患者中表现出持久的抗肿瘤活性和免疫应答。二期疗效试验目前正在进行中[8]。
总结
值得注意的是,超过一半的女性在首次性行为后不久就出现了宫颈HPV感染,但是,大约90%的这种感染在3年内就被清除了。对HPV的免疫力可能是消除病毒的重要因素。涉及巨噬细胞、自然杀伤细胞和自然杀伤T细胞的先天免疫反应可能在对抗HPV感染的第一道防线中发挥作用。在第二道防线中,通过针对HPV16E2和E6蛋白的细胞毒性T淋巴细胞(CTL)进行适应性免疫似乎可以消灭感染HPV16的细胞。由此可见,通过NK细胞之类的非特异性免疫细胞建立第一道防线非常重要,也是第二道防线的基础。
然而,HPV可以逃避宿主的免疫反应。首先,HPV在病毒复制过程中不会杀死宿主细胞,因此既不呈现病毒抗原,也不会引起炎症。HPV16E6和E7蛋白下调宿主细胞中1型干扰素(IFN)的表达。在抗原识别过程中,包括IFNs在内的炎性细胞因子缺乏共刺激信号可能会诱导免疫耐受,而不是适当的免疫反应。在这个过程中,NK细胞及一些非特异性免疫细胞是干扰素分泌的主要细胞。此外,HPV16E5蛋白可下调HLA-1类分子的表达,并有助于逃避毒性T细胞特性行免疫攻击。这些免疫逃避机制可能最终支持HPV持续感染的建立,从而导致宫颈癌的诱发。
因此,从文献报道和临床案例分析来看,输注NK细胞将有助于建立HPV感染第一道防线的建立,同时提高疫苗接种的有效率,也可以在特异性免疫中起到桥梁作用。


